Nos gustaría señalarle algunas de las mediciones más comunes utilizadas para determinar cómo es la calidad del agua y explicárselas de una forma práctica y sencilla. Hoy trataremos sobre el valor pH, el potencial Redox, los microsiemens µS y la dureza del agua.
El valor pH
Con el valor pH se especifica el grado de acidez de los líquidos. La escala va de 0 a 14. Justo en el centro, es decir, un pH de 7 denota un líquido neutro – para el agua potable el pH ideal se encuentra entre 7,2 y 7,4. Cuanto menor sea el valor, más ácido es el líquido. No obstante, la escala del pH debe entenderse de forma que por cada número entero de la escala (es decir, por cada muestra de color de las tiras de medición por colores) el grado de acidez se incrementa en un factor de 10. Por tanto, un estanque con un pH de 6 contiene diez veces más ácido que uno con un pH de 7, y 100 veces más que uno con un pH de 8.

En la otra mitad de la escala, que va de 7 a 14, los líquidos son jabonosos. El pH de la sangre, por ejemplo, debe permanecer constante en un rango muy estrecho entre 7,35 y 7,45, de lo contrario, la persona estaría gravemente enferma. Y existen otros ejemplos interesantes para el pH correcto de un líquido:
La lluvia normal, por ejemplo, tiene un pH de entre 6,5 y 7,4. La lluvia ácida que se da en las zonas industriales suele tener un pH alrededor de 4. La Coca Cola tiene un pH de entre 2,5 y 2,7, casi tan ácido como el vinagre.
Pero también en nuestro cuerpo podemos encontrar fuerte acidez: el jugo gástrico. Por las mañanas, en ayunas, el pH está en torno a 1,5, mientras que la saliva humana se encuentra entre 6,5 y 7,4. Por el contrario, el jugo pancreático con un pH de 8,4 ya se encuentra en la parte muy alcalina y el jabón con un pH normal de entre 9 y 10 ya pica fuertemente en los ojos.
De forma muy sencilla se podría decir que el valor de pH depende de la concentración de iones de hidrógeno (H+). Cuantos más se encuentren en el líquido, más ácido será.
El potencial Redox
El potencial Redox mide el potencial de oxidación-reducción, es decir, la degradación o compactación. El potencial Redox (inglés = oxidation reduction potential = ORP) expresa la capacidad de una molécula para dar o recibir electrones. El potencial de oxidación o de reducción se mide en mV y puede alcanzar tanto valores positivos como negativos. En la naturaleza el potencial Redox se puede encontrar entre +600 mV (oxidación) y -300 mV (reducción), lo que representa la suma de procesos de oxidación y regeneración que se producen en la naturaleza.
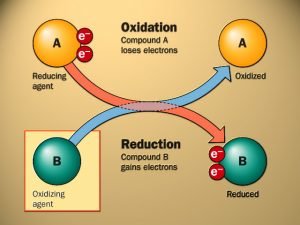
Cuando, por ejemplo, una sustancia reacciona con oxígeno, se produce oxidación. Cuando la madera se quema en el fuego o cuando el hierro se oxida, se produce oxidación. La reducción es exactamente lo contrario, como si, por ejemplo, al óxido se le volviera a extraer el oxígeno y el hierro vuelve a su brillo original.
Los procesos de oxidación sí son útiles, son la base de la obtención de energía vital. Los valores positivos de potencial Redox significan que, por ejemplo, a través de la cesión de electrones el agua promueve la oxidación. Cuanto mayor sea el potencial Redox (p.ej. el Anolyte ácido), mayor y más rápido será la muerte de bacterias, virus, mohos, hongos, esporas, etc. Esto también es así en animales, plantas y en el ser humano, destruyen a los patógenos. Entre +850 y +1000 mV (con un pH de alrededor de 7) todos los microbios están muertos.
Valores de potencial Redox negativos significan que cuanto menor sea el potencial Redox, mayor será el poder de reducción. Los agentes reductores ceden electrones. Los iones cargados negativamente pueden combinarse con los llamados radicales libres (con carga positiva) y convertirlos en inofensivos. Cuanto menor sea el potencial Redox, es decir, cuanta más alcalina sea p.ej. el agua, mayor cantidad de electrones podrá ceder el agua a sustancias oxidantes. Se trata, por tanto, de un captador ideal de radicales libres. Las reacciones Redox son aquellos procesos que aseguran las funciones vitales de los organismos vivos.
Nuestro organismo, y la naturaleza en general, dependen del funcionamiento de ambos procesos. El Anolyte neutro apoya la oxidación por excelencia, para que la reducción se pueda desarrollar plenamente y al mismo tiempo enlazar los radicales libres. Por tanto, si no se apoyara el proceso de oxidación, se preservarían también las bacterias y los gérmenes y permanecerían con vida.
µS – Microsiemens
Los microsiemens se abrevian con el símbolo µS. Esta unidad de medida nos informa sobre la capacidad que tiene un líquido de conducir la corriente eléctrica. Para ello es necesario que el agua contenga minerales. Por tanto, la conductividad eléctrica en µS nos indica cuántas sustancias están disueltas en el agua que puedan conducir corriente eléctrica. Este valor se mide con un medidor TDS (Total Dissolved Solids: total de sólidos disueltos). Sin embargo, muchas de las sustancias disueltas en el agua no dicen nada sobre su calidad.
Una alta conductividad debida a una gran cantidad de calcio, de hecho, nos proporciona una alta conductividad muy deseable en el agua. Por el contrario, un agua puede contener muy pocos sólidos, pero si se trata de arsénico, con 20 µS será suficiente para envenenarme. Por tanto, no se trata de una medida alta o baja de TDS, sino de qué tipo de sólidos – no importa que sea mucha o poca cantidad – son los que están disueltos en el agua.

Louis-Claude Vincent descubrió en los años 50 del siglo pasado, en varias ubicaciones diferentes de Francia, relaciones entre la calidad del agua potable y la incidencia de enfermedades. A partir de tres cosas, es decir, mediciones bajas de sólidos en el agua, un valor de pH ligeramente ácido y un potencial Redox bajo, dedujo que el agua debería ser saludable. Esta teoría realmente nunca fue demostrada científicamente. Cuando se elabora la relación existente entre la conductividad y las enfermedades, pero no se conoce el motivo de dicha conductividad (se trata de minerales o de contaminantes), las conclusiones obtenidas sobre la salud en función de la conductividad incluso se podrían considerar negligentes.
Los trabajos de Vincent ni si quiera habrían llegado a ser populares de no ser por los seguidores de la ósmosis inversa que encontraron en ella una teoría que confirmaba la ingesta de agua de ósmosis.
Dureza del agua
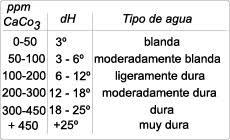
Bajo dureza del agua se entiende la concentración de iones de calcio y magnesio. El contenido de sales de calcio y magnesio determina las propiedades del agua. Cuanto mayor sea su proporción, más dura será el agua. Desde luego que esta dureza del agua no es perjudicial para la salud. El calcio y el magnesio son disueltos poco a poco de los estratos de roca y por medio del agua de lluvia son arrastrados hasta el agua subterránea. Por tanto, la lluvia ácida puede aumentar fuertemente la dureza del agua.
Pero existe otro rango de dureza que no es tan fácil de eliminar. Se trata de la dureza no carbonatada. Esta parte de la dureza que es muy difícil de eliminar está compuesta de aniones como p.ej. cloruros, nitratos y sulfatos enlazados con el agua. Esta es la dureza residual del agua, porque sólo es posible verla una vez que el agua se haya evaporado completamente. Los cloruros suponen una carga en el agua que forma depósitos. Un contenido elevado de sulfatos también produce la formación prematura de depósitos. El aumento significativo de la conductividad ya es un indicio de la influencia de agua contaminada en el agua subterránea. Actualmente puede medir con bastante precisión la dureza de su agua con analizadores muy económicos.
Los nitratos son otro indicador de contaminación que produce alta conductividad en el agua potable. La dureza procedente de nitratos se forma debido a fertilizantes de nitrógeno orgánico e inorgánico, o por la filtración de aguas residuales. Otra causa del contenido de nitrógeno en el suelo que conduce a la formación de nitratos es el resultado de la descomposición de las proteínas vegetales. Actualmente existen tiras reactivas para medir el nivel de nitratos en el agua.

Los nitratos son realmente peligrosos cuando durante el proceso digestivo, y en combinación con bacterias, se convierten en nitritos. Después, en el torrente sanguíneo, los nitritos oxidan la hemoglobina de la sangre. El hierro que contiene la sangre pierde entonces su capacidad para distribuir el oxígeno. Sin oxígeno nuestros órganos reaccionan con fermentación y destrucción. Afortunadamente los filtros de agua están avanzando mucho en lo que a la eliminación de nitratos en el agua se refiere.
Los fosfatos, en cambio, se utilizan como suavizante. Por simplicidad, la dosificación de fosfatos se conoce como descalcificación. Pero en realidad, esto no es del todo correcto, ya que este tipo de tratamiento del agua no elimina los iones de calcio y magnesio sino que simplemente evita su cristalización. Por tanto, con esta medida se pretende la estabilización de la dureza y no la eliminación de los compuestos que generan la dureza.

Los fosfatos en el agua favorecen los gérmenes así como también reacciones directas como la “enfermedad del fosfato”. Esta es debida a un exceso de fosfatos que provoca hiperactividad en el ser humano y sobre todo en los niños. El límite establecido para los fosfatos contenidos en el agua potable, según mis investigaciones, se situaba en 6,7 mg/l. Sin embargo, desde hace algunos años ya no aparece en la regulación para el agua potable.
En el ámbito técnico la descalcificación se produce por medio de distintas medidas:
• Destilación
• Precipitación con carbonato sódico o fosfato de sodio
• Con intercambiadores de iones por medio de los llamados equipos de descalcificación, polifosfatos
• En el hogar por medio de los suavizantes incorporados en detergentes y productos de limpieza (fosfatos)
• En la mayoría de los casos se trata de fosfato alimentario
• Desde hace algunos años, una de las nuevas formas de descalcificación es el cultivo de semillas cristalinas. Esto produce una protección anti cal gracias a los núcleos de cristalización que aumentan la estructura molecular lo que permite su posterior filtración. El principio es conocido en la naturaleza en el cultivo de perlas.
Sin embargo, en la mayoría de los hogares se descalcifica con un intercambiador de iones. Estos deben ser regenerados con cloruro de sodio, por lo que contaminan en gran medida el agua residual y nuestra salud. Ya que esto eleva enormemente la concentración de sodio en el agua potable.
El término de dureza no está normalizado en Europa. En España se mide según los grados de dureza franceses: 15 a 25 ºfH se designa como duro. Todo lo que se encuentre por encima se considera muy duro.
Los problemas causados por el agua tienen graves consecuencias y deberían eliminarse a toda costa, aunque sea a base de dar la lata a nuestro proveedor de agua local incluso, si es posible, con el apoyo de vecinos afectados cuando se trata de problemas graves. Probablemente esto nos cueste tiempo, paciencia y quizás también dinero. Si este precio es demasiado alto, al menos elija un buen filtro de agua para su hogar.
Marion Kuprat



